新聞網(wǎng)訊 近日�,基礎(chǔ)醫(yī)學(xué)院醫(yī)學(xué)藥理學(xué)系陳雪紅課題組在《Journal of Nanobiotechnology》(IF=10.2,中科院1區(qū))發(fā)表題目為 “Reactive oxygen species/glutathione dual sensitive nanoparticles with encapsulation of miR155 and curcumin for synergized cancer immunotherapy”的研究論文( DOI:10.1186/s12951-024-02575-5)���。該論文由基礎(chǔ)醫(yī)學(xué)院醫(yī)學(xué)藥理學(xué)系研究團隊完成����,博士研究生李康康為第一作者����,陳雪紅教授為通訊作者,青島大學(xué)基礎(chǔ)醫(yī)學(xué)院為第一署名單位�,該研究受到山東省自然科學(xué)基金資助。
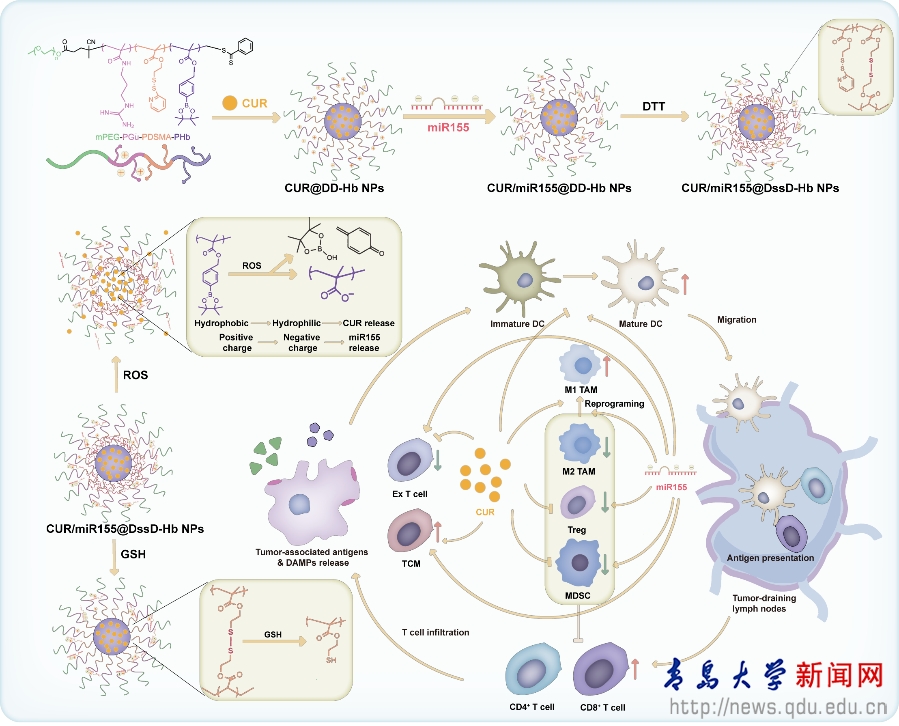
最近研究表明�����,miR-155可以促進M2型腫瘤相關(guān)巨噬細(xì)胞(TAM)向M1表型的極化�����,刺激DC細(xì)胞成熟并促進T細(xì)胞激活�,但是miR-155會誘導(dǎo)調(diào)節(jié)性T細(xì)胞(Treg)和髓源性抑制細(xì)胞(MDSC)等免疫抑制細(xì)胞的募集。姜黃素(CUR)可以抑制Treg和 MDSC在腫瘤微環(huán)境中的募集并促進M2型TAM向M1表型的極化�。因此,miR155聯(lián)合CUR可以最大限度地減輕誘導(dǎo)的免疫抑制�,從而增強抗腫瘤免疫反應(yīng)。因此����,設(shè)計了活性氧/谷胱甘肽雙重響應(yīng)藥物遞送系統(tǒng)(CUR/miR-155@DssD-Hb NPs)用于CUR和miR-155的共遞送。體內(nèi)外實驗結(jié)果表明����,CUR/miR-155@DssD-Hb NPs可有效抑制4T1和B16-F10腫瘤細(xì)胞活性,誘導(dǎo)損傷相關(guān)分子模式(DAMPs)的釋放�,刺激DC成熟����,促進CD8+T細(xì)胞激活��,減少免疫抑制細(xì)胞在腫瘤部位的募集(如MDSC�、Treg和M2 TAM),促進長期免疫的形成并減少肺轉(zhuǎn)移性結(jié)節(jié)的形成����。總之���,CUR和miR-155的共遞送系統(tǒng)顯示出用于黑色素瘤和三陰性乳腺癌免疫治療的潛力��。






![]() 魯公網(wǎng)安備 37021202000856號
魯公網(wǎng)安備 37021202000856號 ![]()